Урок № 58
Робота в термодинаміці. Перший закон термодинаміки. Адіабатний процес
Словник:
Адіабатним називається процес, який відбувається в термодинамічній системі без теплообміну з навколишнім середовищем.
1. Робота в термодинаміці.
2. Як можна графічно визначити роботу газу?
3. Який фізичний зміст має універсальна газова незмінна?
| ||
1. Термодинамічна робота здійснюється тілами в разі зміни їхнього об'єму. Оскільки тверді й рідкі тіла в ході нагрівання розширюються незначною мірою, то незначною є і здійснювана ними робота. Роботу в термодинаміці може здійснювати тільки газ, який під час нагрівання значно змінює свій об'єм.
Робота
ідеального газу при ізобарному нагріванні газу є добутком тиску газу на зміну
його об'єму:
Графічний зміст роботи
газу: робота ідеального чисельно дорівнює площі фігури, обмеженої графіком
залежності р від V, віссю V і
ординатами початкового і кінцевого стану газу.
Демонстрація
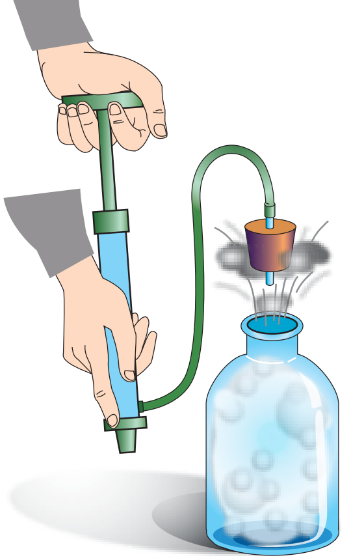
1. У товстостінну посудину накачують повітря. Через деякий час корок вилітає з
посудини. Спостерігається
утворення туману.
Демонстрація 2.
«Повітряне кресало».На дно прозорого циліндра з поршнем кладуть шматочок вати і
різко ударяють по штоку поршня. Вата у циліндрі спалахує і згоряє.
Що призвело до
спалахування вати? Який висновок можна зробити щодо зміни внутрішньої енергії
газу, який знаходився в циліндрі?
Отже, робимо висновок:
якщо газ сам виконує роботу, то його внутрішня енергія зменшується; якщо робота
виконується над газом, то його внутрішня енергія збільшується.
Роботу, яку виконує
система, вважають доданою, а роботу, яку виконують зовнішні сили над
системою,— від'ємною.
2. Нехай газ міститься в
посудині з теплоізольованими стінками, через які тепло не проникає ні в
посудину, ні в навколишнє середовище. За таких умов процес, який протікає в
газі, називається адіабатним.
Адіабатним називається
процес, який відбувається в термодинамічній системі без теплообміну з
навколишнім середовищем.
На рис. адіабата схожа
на ізотерму, але має більш крутий вигин. Це пояснюється тим, що під час
адіабатичного стиснення збільшення тиску газу зумовлено не тільки зменшенням
його об'єму, а й підвищенням температури. При адіабатичному розширенні
температура знижується, при стисненні — підвищується.
3. Завдяки
дослідженням багатьох вчених, у першу чергу німецького лікаря Р. Майера,
англійського фізика Д. Джоуля й німецького фізика Г. Гельмгольца, було
встановлено, що в ізольованих системах, в яких відбуваються непружні деформації
чи є в наявності тертя між частинами системи, зменшення механічної енергії
завжди дорівнює збільшенню внутрішньої енергії системи, а повна енергія при
цьому зберігається.
Закон збереження і
перетворення енергії, поширений на теплові явища, називається першим
законом термодинаміки.
Зміна внутрішньої
енергії при переході її з одного стану в інший дорівнює сумі
роботи зовнішніх сил А та кількості теплоти, переданої системі:
Якщо система сама
виконує роботу над зовнішніми тілами, то перший закон термодинаміки можна
сформулювати так: кількість теплоти передана системі, витрачається на зміну її
внутрішньої енергії і на здійснення системою роботи над зовнішніми
силами:
Перший закон термодинаміки – це закон збереження енергії, який поширюється на теплові явища.
Закон збереження енергії
Енергія в природі не виникає з нічого і не зникає: кількість енергії незмінна, вона тільки переходить з однієї форми в іншу.
Енергія в природі не виникає з нічого і не зникає: кількість енергії незмінна, вона тільки переходить з однієї форми в іншу.
Закон збереження енергії керує всіма явищами природи і зв’язує їх воєдино. Він виконується абсолютно точно, не відомо жодного випадку, коли б цей закон не виконувався.
4. Принцип збереження енергії говорить, що енергія не може бути створена чи зруйнована, але вона може переходити з однієї форми в іншу. Таким чином, у будь-якій ізольованій або замкнутій системі, сума всіх видів енергії залишається незмінною.
Джоуль, Майєр і Гельмгольц довели еквівалентність тепла і роботи, показавши експериментально, що кожній визначеній роботі завжди відповідає певна кількість теплоти. Робота французького вченого Карно “Роздуми про рушійну силу вогню і про машини, які здатні розвивати цю силу” відіграла особливу роль у розвитку термодинаміки. Він писав: “Тепло – це механічна енергія, яка змінила свій вигляд: це енергія руху частинок тіла. Коли відбувається знищення механічної енергії, виникає одночасно теплота в кількості, яка точно дорівнює кількості механічної енергії, що зникла. І, навпаки, при зникненні теплоти завжди виникає механічна енергія. Таким чином, енергія існує в природі в незмінній кількості; вона ніколи не створюється і ніколи не знищується, змінюючи лише свою форму.
Робота Карно була оцінена лише в 1834 році, коли Клапейрон, повторивши міркування Карно, ввів графічний метод опису процесів. Теорема Карно увійшла в термодинаміку в якості фундаментального принципу, а сама робота Карно, викладена Клапейроном і надрукована в 1843 році на німецькій мові, стала початком досліджень У. Томсона і Р. Клаузіуса, що призвели до відкриття другого закону термодинаміки.
ЗАКРІПЛЕННЯ МАТЕРІАЛУ
І. Розвязування задач
1. Наскільки змінилася внутрішня енергія деякого газу, який виконав роботу 50 кДж, отримавши кількість теплоти 1985 кДж?
2. Визначте роботу зовнішніх сил над системою, якщо система віддала кількість теплоти 3,2 кДж і її внутрішня енергія збільшилася на 2,2 кДж.
3. Для ізобарного нагрівання 20 міль газу на 200 К йому передали кількість теплоти 1983 кДж. Яку роботу здійснив газ? Яка зміна внутрішньої енергії?
Розв’язок
При ізобарному нагріванні газ здійснив роботу

З рівняння Клапейрона - Менделеєва pV = vRT, можна записати:

З першого закону термодинаміки отримуємо? U = Q – Aг.
Перевіримо одиниці вимірювання:

Підставляємо числові значення величин:

4. При стисненні газу в циліндрі зовнішня сила, що діє на поршень, здійснює роботу, яка дорівнює 100 Дж. Чому дорівнює зміна внутрішньої енергії газу, якщо завдяки теплопровідності циліндра він віддає в навколишнє середовище кількість теплоти 20 Дж?
ІІ. Запитання для перевірки
1. Наслідком якого закону є перший закон термодинаміки?
2. Чи може зміна внутрішньої енергії системи бути негативною?
3. Чи може внутрішня енергія системи залишитися незмінною, якщо вона одночасно бере участь у теплообміні й здійснює роботу?
4. При різкому опусканні поршня об’єм газу в циліндрі зменшується вдвічі. Чи можна стверджувати, що тиск газу при цьому зростає вдвічі?
– Енергія в природі не виникає з нічого і не зникає: кількість енергії незмінна, вона тільки переходить з однієї форми в іншу.
– Зміна внутрішньої енергії тіла дорівнює сумі кількості теплоти, переданого тілу, і роботи, що здійснюється над тілом:

– Кількість теплоти, яка передається тілу, дорівнює сумі зміни внутрішньої енергії тіла і роботи, яку воно виконує:



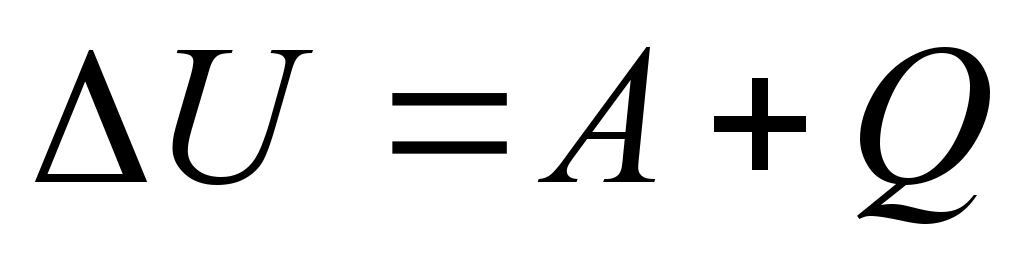


Немає коментарів:
Дописати коментар